BLOG INFORMATIVO
AUTOR
SELENE ESTRADA
CÁNCER DE MAMA
mas informacion aqui

I.- INTRODUCCIÓN
III.- JUSTIFICACIÓN
II.- ANTECEDENTES
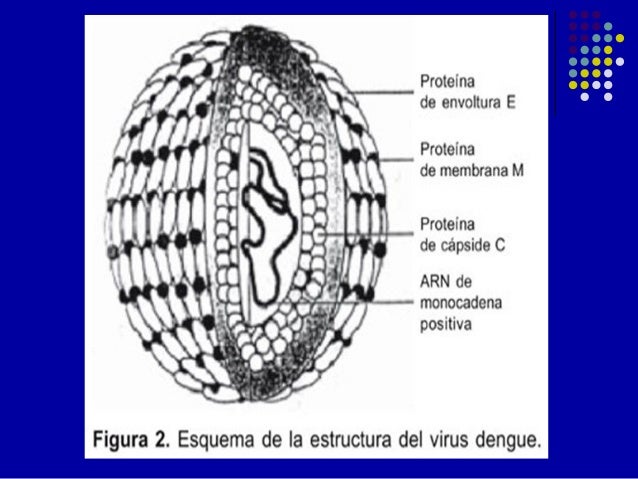
1.2.- Flavivirus

2.- Perspectiva histórica del Virus del Dengue (DENV)
4.- Transmisión
4.2.- El vector

4.3.- El hospedero

5.- Clasificación de caso de Dengue / Manifestaciones
clínicas

VI.- METODOLOGÍA
1.- Pruebas moleculares 1.1.- Muestras biológicas

1.2.- Determinación del antígeno viral (NS1) por
ELISA
.-
CONCLUSIONES
más información aqui :video del dengue
CÁNCER DE MAMA
mas informacion aqui
SEMESTRE:
SEGUNDO
PARALELO:
C
TEMA:
DENGUE
2019

RESUMEN
Presenta:
Trabajo integrador. Selena Nataly Estrada Olivares. Fecha de entrega 15/03/2019 terminación del
segundo en el ISTEC
Introducción. - El
dengue es la principal enfermedad arboviral transmitida por vector, la cual es
ocasionada por cualquiera de los cuatro serotipos del Virus del Dengue
(DENV-1-4). La OMS estima que 2.5 billones de personas se encuentran en riesgo
por esta infección y que 50 millones de casos ocurren anualmente a nivel mundial.
En México, durante el 2019 se reportó la circulación de los cuatro serotipos de
este virus, específicamente en Nuevo León, la Secretaría de Salud reportó 2272
casos de Dengue de los cuales la mayoría se debieron a infecciones por el
DENV-1. Aunque existen reportes de la vigilancia epidemiológica en el país, el
reporte de los genotipos virales es limitado.
Objetivo. - Identificar y
analizar las variantes genéticas de los virus del dengue circulantes, así como
su asociación en la dinámica de la transmisión de estos en la provincia Sucumbíos.
Material y Métodos. - Se
empleó método de Máxima Probabilidad (ML) así como un valor de soporte de 100
replicaciones para la realización del análisis filogenético de genomas virales
del DENV-1 aislados durante el brote epidémico de dengue que tuvo lugar en
Nueva Loja durante el 2019. .
Resultados. - Se
estimó la relación filogenética de 36 genomas del DENV-1 (2019) encontrando que
estos pertenecen al genotipo V América.
Conclusión. - Se
logró la identificación de las variantes genéticas del DENV-1 circulantes en
Nuevo León durante el 2010. Además, se determinó un 3% de prevalencia de
anticuerpos antiDENV en donadores asintomáticos
I.- INTRODUCCIÓN
Muchas
de las enfermedades emergentes que amenazan la salud pública mundial son
transmitidas por vectores artrópodos y constituyen un problema global cuyo
impacto social y económico es enorme [1, 2].
Entre
los principales vectores de enfermedades se encuentran los mosquitos los cuales
son capaces de transmitir: malaria, fiebre amarilla, dengue, encefalitis,
filariasis y fiebre del oeste del Nilo [2-4].
Con
respecto a lo anterior, el dengue es una enfermedad ocasionada por la infección
con cualquiera de los cuatro serotipos del virus del dengue (DENV-1-4) los
cuales son transmitidos al hombre por la picadura de mosquitos del género
Aedes.
Ha
sido señalado que el aumento en los casos de dengue puede atribuirse a tres
factores principalmente, siendo el primero el incremento en la urbanización y
en la densidad poblacional, lo que conduce a un aumento de sitios criaderos del
vector y a un mayor contacto entre el vector y el huésped; en segundo lugar, la
invasión global de los principales vectores Aedes aegypti y Aedes albopictus lo
que conduce a un incremento en la distribución geográfica y la co-circulación
de los cuatro serotipos del virus; finalmente, la interacción y evolución de
los cuatro serotipos, resulta en un incremento en la severidad [5-9]. Por lo
anterior, el dengue se considera como la enfermedad viral transmitida por
mosquitos de más rápida distribución en el mundo, lo que aunado con su severidad
la ha llevado a convertirse en la infección arboviral más común en regiones
tropicales y subtropicales del mundo [7, 10-12].
La
Organización Mundial de la Salud estima que anualmente ocurren 50 millones de
infecciones y que aproximadamente 2.5 billones de personas que viven en zonas
endémicas se encuentran en riesgo de contraer la infección cada año [10].
III.- JUSTIFICACIÓN
El
comportamiento endémico de la fiebre por dengue, así como el incremento en el
número de casos de dengue hemorrágico en México durante los últimos años han
generado gran preocupación en todos los sectores relacionados con la salud.
Los
esfuerzos para interrumpir la transmisión se han concentrado en el control
vectorial; por lo que resulta importante establecer con claridad cuáles son los
elementos determinantes de la transmisión del dengue para establecer medidas de
control y vigilancia eficaces.
Dado
que entre los factores de riesgo para el desarrollo de las formas graves de la
enfermedad por el virus del Dengue se encuentran el factor inmunológico el cual
está representado por la inmunidad pre-existente dada por una infección previa
con el virus así como el genotipo viral infectante es de suma importancia la
evaluación de estos factores.
En
cuanto a los determinantes moleculares de la transmisión, el análisis
filogenético de las variantes genéticas del DENV ofrecerían una visión más
clara de la relación entre las variantes existentes y la severidad de la
enfermedad en nuestra población.
1.- Objetivo general
Identificar
y analizar las variantes genéticas de los virus del dengue circulantes, así
como su asociación en la dinámica de la transmisión de esta provincia.
2.- Objetivos específicos
2.1.-
Aislar e identificar las variantes genéticas del virus del dengue circulantes
en Nueva Loja en el período de marzo del 2019 a Diciembre del 2019.
2.2.-
Determinar la memoria inmunológica existente en habitantes del cantón de Nueva
Loja, ecuador contra el virus del dengue en periodos epidémicos e interepidémicos.
2.3.-
Analizar las variantes genéticas del virus del dengue aisladas y su asociación
con la dinámica de la transmisión en las áreas estudiadas.
1.- Los virus
Los
virus como patógenos causantes de enfermedades en el hombre se pueden encontrar
en muchas páginas de la historia de la humanidad ya que han sido causales de un
gran número de epidemias a lo largo de la historia universal.
Hasta
fines del siglo XIX se conocía la etiología de muchas enfermedades infecciosas,
sin embargo para un gran número de enfermedades no solo del hombre sino de
plantas y animales permanecía sin identificarse el agente causal, siendo hasta
el siglo XX que se descubrieron a los virus como causantes de enfermedades
infecciosas.
Las
primeras características diferenciales de los virus con respecto a otros
agentes infecciosos fueron: el tamaño, estimado por su capacidad de atravesar
filtros que retienen a las bacterias y la incapacidad para reproducirse en
medios biológicos inertes, requiriendo para su propagación de animales o
cultivos celulares, características que actualmente no son exclusivas de estos
agentes.
Según
su definición los virus son parásitos intracelulares obligados de tamaño
submicroscópico. Sin embargo, para contar con una definición adecuada es
necesario adicionar algunas cláusulas adicionales como que las partículas
virales son producidas a partir de componentes ensamblados o preformados, no
crecen o se someten a división, esto en comparación con otros agentes que
crecen por un incremento de la suma integrada de sus componentes y se
reproducen por división. Además, los virus carecen de información genética que
codifica para el aparato necesario para la generación de energía metabólica o
para la síntesis de proteínas por lo que depende absolutamente de la célula
huésped para su funcionamiento [13].

1.2.- Flavivirus
De
acuerdo al Comité Internacional de Taxonomía de Virus (ICTV), los Flavivirus
(del latín flavi ‘amarillo’), comprenden uno de los tres géneros que componen
la familia viral Flaviviridae la cual comprende alrededor de 70 virus envueltos
cuyo genoma está constituido por ARN de polaridad positiva, los otros dos son
los géneros Pestivirus (del latín pestis ‘plaga’) y Hepacivirus (del griego
hepar, hepatos ‘hígado’), aunque estos últimos poseen estrategias de
replicación similares a las de los flavivirus, estos grupos son antigénicamente
distintos, no son transmitidos por artrópodos y representan linajes que
divergieron tempranamente en la evolución de esta familia viral [14]. Por otro
lado, se sabe con certeza a través de la evidencia geográfica que el progenitor
de las aproximadamente 80 especies que constituyen el género Flavivirus surgió
en África [15].
Con el
curso de la especiación, los flavivirus han mostrado una diversificación
substancialmente ecológica, lo cual se puede evidenciar con las diversas formas
de transmisión de los diferentes linajes de los flavivirus, ya que estudios
filogenéticos del género sugieren que el ancestro pudo haber sido un virus de
mosquitos solamente el cual, posteriormente adquirió la habilidad de infectar
vertebrados, los demás flavivirus se dividen en virus transmitidos a
vertebrados mediante vector, cuyos mayores grupos emplean garrapatas y
mosquitos para su transmisión horizontal, y otro grupo el cual infecta
vertebrados sin el uso de artrópodos vectores. Lo anterior no sugiere si los
transmitidos por vector o sin vector fueron ancestrales pero la posición de los
virus que infectan solamente mosquitos sugiere que la transmisión a través de
mosquitos a los vertebrados precedió a la perdida de la transmisión por vector.
La transmisión a través de garrapatas pudo haber evolucionado del linaje
transmitido por mosquitos después de que el linaje que infecta solo vertebrados
surgió [15].
A la
fecha todos los flavivirus conocidos como patógenos de humanos son transmitidos
por vectores, y con la excepción de los virus del Dengue.
De las
proteínas estructurales, la glicoproteína de envoltura es esencial para la
entrada viral a la célula ya que contiene el sitio de unión para el aún no
identificado receptor celular, dentro del endosoma la proteína de envoltura.

2.- Perspectiva histórica del Virus del Dengue (DENV)
La
fiebre del dengue es posiblemente tan antigua como la humanidad, el registro
más antiguo encontrado hasta la fecha de la enfermedad por dengue se encuentra
en una enciclopedia china de síntomas y remedios de enfermedades, la cual fue
publicada por primera vez durante la dinastía China (265 a 420 d.C.) y editado
oficialmente en el 610 d.C. (dinastía Tang), y nuevamente en 992 d.C. (dinastía
Sung del Norte). La enfermedad fue nombrada por los chinos como envenenamiento
del agua y se pensaba que de alguna manera estaba relacionada con los insectos
voladores asociados al agua [9].
Aproximadamente
dos mil años después, los primeros brotes de una enfermedad compatible con la
fiebre de dengue clásico tomo lugar en el Caribe en 1635 y 1699, mucho antes de
que se reportaran las epidemias de 1779 y 1780 que se produjeron
simultáneamente en Asia, África y Norte América. Estos acontecimientos
describieron por primera vez evidencia de la amplia distribución geográfica de
esta (o al menos de una enfermedad muy similar al dengue), alcanzando
proporciones pandemicas para 1788. Siendo en 1789 cuando Benjamin Rush reportó
el primer caso de la enfermedad y acuño el termino de ‘fiebre quebrantahuesos’[8].
Los registros históricos también indican una segunda serie de pandemias de
dengue o enfermedades similares a dengue que cruzaron el mundo de África a
India a Oceanía y a América, de 1823 a 1916, con una duración de 3 a 7 años
[17]. Interesantemente, esta amplia distribución geográfica del dengue
coincidió con el aumento en el comercio global ayudado por los barcos de vela.
Desde
entonces, grandes brotes se han reconocido mundialmente cada 20-40 años. La
ausencia de dengue epidémico de 1946 a 1963 puede ser atribuido al éxito
parcial de los programas de erradicación de Aedes aegypti diseñados para la
prevención de la fiebre amarilla [5, 8, 18, 21].
La
segunda guerra mundial causó cambios ecológicos y demográficos significativos, hipnotizándose
que el movimiento de tropas y civiles, el aumento en el número de individuos
susceptibles en áreas endémicas, la destrucción del ambiente, el transporte de
carga, la expansión económica, la continua.
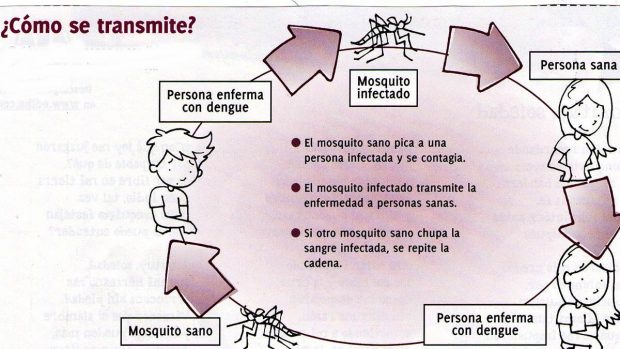
4.- Transmisión
4.1.- Agente etiológico
La
partícula madura del virus del dengue es esférica con un diámetro de 50 mm que
contiene múltiples copias de las tres proteínas estructurales, la membrana
derivada del huésped y una sola copia del genoma de ARN de cadena sencilla y
sentido positivo [10].
El
genoma del virus consta de 10,703 nucleótidos, los cuales se traducen para
generar una poliproteína precursora (figura 9) la cual es co- y
pos-traduccionalmente procesada por proteasas virales y celulares para producir
las proteínas virales que son tres proteínas estructurales (cápside C, el
precursor de membrana que dará origen a la proteína M, la proteína de
envoltura (E) y siete proteínas no estructurales.
El
Virus del dengue se clasifica en cuatro serotipos (DENV-1, DENV-2, DENV-3 y
DENV-4) los cuales difieren en aproximadamente el 30% de los nucleótidos a
través de su genoma [27]. Debido a lo anterior, distintos genotipos o linajes
(virus altamente relacionados en su secuencia nucleotídica) se han identificado
dentro de cada serotipo, lo que resalta la extensa variabilidad genética de los
serotipos del dengue. Sin embargo, los virus transmitidos por artrópodos
(Arbovirus) han mostrado menores tasas de mutación comparados con virus que
infectan directamente a humanos como la Influenza, HIV o Coronavirus,
probablemente debido al efecto de compensación que se produce debido a que el
virus está obligado a adaptarse alternativamente en el vector invertebrado y el
hospedero vertebrado.
4.2.- El vector
El
principal vector del virus del dengue es el mosquito Aedes aegypti, el cual es
una especie antropofílica de distribución cosmotropical que se presenta en todo
el mundo dentro de los isotermas de 20 °C, la cual está bien adaptada al
ambiente urbano, pudiéndose encontrar afuera en la proximidad o adentro de las
viviendas humanas. Su eficiencia como vector radica en que este deposita sus
huevos en contenedores artificiales de agua limpia como neumáticos, latas,
frascos, macetas entre otros, y que se alimenta por picadura de la sangre de
humanos las cuales son por lo general durante la mañana o al atardecer [21,
35].
En
cuanto a su descripción morfológica, Aedes aegypti es un mosquito de color negro con anillos
blancos en las patas y una figura de color blanco plateado en forma de lira en
la parte superior de su tórax, también posee bandas blancas en los tarsos
posteriores y el abdomen [35].
Por
otra parte el mosquito Aedes albopictus (figura 11) es el vector secundario del
virus del dengue en el sureste de Asia, el pacífico occidental y crecientemente
en Centroamérica y Sudamérica [21]. Tiene una apariencia muy similar a la de
Aedes aegypti con un cuerpo negro y marcas blancas en las patas, la diferencia
principal entre los dos es que A. albopictus tiene una sola línea
blanca-plateada en el centro del dorso del tórax [35].

4.3.- El hospedero
Los
humanos son los principales hospederos amplificadores del virus. El virus
circulante en la sangre de humanos virémicos es ingerido por mosquitos hembras
durante su alimentación. El virus infecta el intestino medio del mosquito y
subsecuentemente se distribuye sistemáticamente durante un periodo de 8-12
días. Después de este periodo de incubación extrínseca, el virus puede ser
transmitido a otros humanos durante las siguientes alimentaciones. El periodo
de incubación extrínseco está influenciado en parte por condiciones
ambientales, especialmente la temperatura ambiente. A partir de entonces el
mosquito permanece infectivo por el resto de su vida.

5.- Clasificación de caso de Dengue / Manifestaciones
clínicas
Según
la Organización Mundial de la Salud (WHO), el dengue tiene un amplio espectro
de presentaciones clínicas, a menudo con una evolución clínica y desenlace impredecible. Mientras que la mayoría de los
pacientes se recuperan después de un curso clínico autolimitado y no severo,
una pequeña proporción progresa a enfermedad severa, mayormente caracterizada
por fuga plasmática con o sin hemorragia. La rehidratación intravenosa es la
terapia de elección; esta, puede reducir la tasa de casos fatales de las formas
severas a menos de 1%. La progresión de enfermedad no-severa a severa es
difícil de definir, pero es un asunto importante ya que el tratamiento
apropiado puede prevenir que estos pacientes desarrollen condiciones clínicas
mas severas [10].
En
cuanto a las manifestaciones clínicas, la infección con cualquiera de los
serotipos del virus puede ocasionar un amplio rango de enfermedades en humanos,
entre las que se encuentran: infecciones asintomáticas, subclínicas, fiebre del
dengue (dengue clásico) es una enfermedad febril debilitante y autolimitada que
tiene entre sus manifestaciones clínicas: dolor de cabeza, dolor retro-orbital,
mialgia, artralgia y rash, la cual rara vez amenaza la vida, o las formas
severas que son el dengue hemorrágico el cual se caracteriza por el incremento
en la permeabilidad vascular (fuga de plasma), además de presentarse
trombocitopenia y manifestaciones hemorrágicas y el síndrome de shock por
dengue el cual ocurre cuando la fuga de fluidos a los espacios intersticiales
resulta en shock hipovolémico el cual sin tratamiento apropiado puede conducir
a la muerte para las cuales la tasa de casos fatales varia de 1 al 5% [21, 36,
37]. El periodo de incubación varia de 3 a 14 días (promedio 4-7 días). En
áreas donde el dengue es endémico, la enfermedad es a menudo clínicamente
inespecífica.

ÁREA DE ESTUDIO
El
área de estudio estuvo comprendida por el estado de Nueva Loja el cual se
encuentra en la cabecera cantonal Tiene una superficie de 64,220 km2, lo cual
representa el 3.3% de la superficie total del país.
Cuenta
con una población de 4,199,292 lo que representa aproximadamente el 4.0% de la
población total del país.
El
clima es principalmente caluroso y húmedo, pero tiene temperaturas templadas en
las áreas más altas, heladas en invierno y una fuerte temporada de lluvias a
veces acompañada de huracanes.
VI.- METODOLOGÍA
Para
cumplir con el objetivo de este trabajo se siguió la metodología descrita en
este apartado y esquematizada.
Destacando
que para el control de calidad de los procedimientos aquí descritos se
utilizaron controles positivos y negativos, así como valores de referencia.
a)
Cero tipificación Control positivo: Sueros positivos para los diferentes
serotipos o cultivos celulares infectados con los diferentes serotipos del
virus del dengue. Control negativo:
Agua Valores
de referencia para PCR: Muestras con menores o iguales a 35 son positivas.
Muestras
con entre 36 y 38, se repiten por duplicado. Muestras con mayores o iguales a
40 son negativas. PCR gen E Todas las muestras de pacientes deberán correrse a
la par con controles negativos y positivos y se excluyeron los resultados en
los que:
a) El control positivo no presente las bandas
de amplificación del tamaño esperado.
b) El control negativo presente cualquier
banda de amplificación.
c)
Cuando no se corra cualquiera de los controles especificados.
1.- Pruebas moleculares 1.1.- Muestras biológicas
La
muestra para utilizar fue suero de pacientes febriles que presenten a su vez
dos o más signos de infección por virus del Dengue según la clasificación
descrita en la NOM017SSA2-1994.
A cada
uno de los pacientes incluidos en el estudio, se les tomo una muestra de sangre
(~5 mL) en tubos vacutainer al vacío usando tubos sin anticoagulante para suero
(tapa roja), se separó el suero y se almacenó de 2 a 8°C hasta 72 horas o
congeló a –70°C o menor. En caso de que se requiriera el transporte de la
muestra, fue en red fría de 2 a 8°C o congelada.

1.2.- Determinación del antígeno viral (NS1) por
ELISA
El
suero de pacientes sospechosos de la infección con dengue fue posteriormente
sometido a una prueba serológica de ELISA para la detección de la proteína no
estructural del virus NS1 mediante el kit comercial PanBio No. catálogo
E-DEN01P. Siguiendo las recomendaciones del fabricante descritas a
continuación: 1.-Colocar 100 µl de muestras diluidas y controles en sus
respectivos micropozos. 2.-Cubrir la placa e incubar por 1 hora a 37°C ± 1°C.
3.-Lavar
seis (6) veces con buffer de lavado diluido. 4.-Colocar 100 µl de HRP conjugado
anti-NS1 Mab a cada pozo. 5.-Cubrir la placa e incubar por 1 hora a 37°C ±1°C.
6.-Lavar seis (6) veces con buffer de lavado diluido. 7.-Colocar 100 µl de TMB
a cada pozo. 8.-Incubar por 10 minutos a temperatura ambiente (20-25°C) a
partir de la primera adición. Se desarrollara un color azul. 9.- Agregar 100 µl
de solución de paro a todos los pozos en la misma secuencia y tiempo
sincronización de la adición de TMB. Mezclar bien. El color azul cambiara a
amarillo. 10.- Dentro de 30 minutos leer la absorbancia de cada pozo a una
longitud de onda de 450 mm con un filtro de referencia entre 600-650 mm.
Una
vez que se determinó la presencia del antígeno viral NS1 se procedió a la
confirmación y serotipificación por q PCR y PCR.
 .-
DISCUSIÓN
.-
DISCUSIÓN
La Secretaria
de Salud reportó la circulación de los cuatro serotipos del virus del Dengue
durante el 2018 en lago agrio. También en otros países latinoamericanos se han
reportado los 4 serotipos, lo que favorece la incidencia de más casos de
infecciones secundarias, y en consecuencia, un aumento del riesgo de DH/SSD.
Por otro lado,
se ha reportado que cada 3 a 4 años una reducción de la incidencia es inmediatamente
seguida por 2 ó 3 años de aumento del número registrado de pacientes. Este
mismo patrón se refleja en los casos reportados en los panoramas epidemiológicos
de dengue del 2018 al 2019 por la SSA en Nueva Loja.
.-
CONCLUSIONES
La
caracterización genética del DENV es un parámetro de gran importancia para
entender los patrones epidémicos de distribución viral.
La relación
filogenética de las 36 cepas aisladas de DENV-1 durante el 2018 y
analizadas en
este estudio demuestra que pertenecen al genotipo V América-África. Además se
observó que estas se agruparon 3 diferentes linajes de DENV-1 que cocircularon
durante el 2018.
El análisis de
los linajes que co-circularon en 2018, utilizando la información
Epidemiológica
de los casos, demostró que el linaje 1 comprende 8 aislados los cuales se
relacionaron con secuencias de ecuador
del 2018 lo anterior es soportado por un valor de bootstrap de 67, anidado a
este linaje se encontró un linaje número dos el cual comprendió la mayoría de
los aislados (21) con un valor de soporte de 89 y por último se encontró un tercer
linaje el cual esta soportado por un bootstrap de 100 el cual incluyo 9 aislados,
los cuales provenían de casos mayoritariamente de Nueva Loja.
más información aqui :video del dengue
.- BIBLIOGRAFÍA
1. Lavezzo, L.C., et al., Arboviruses in blood donors:
a study in the Amazon region and in
a small city with a dengue
outbreak. Transfus Med,
2010. 20(4): p. 278-9.
2. Weaver, S.C. and W.K. Reisen, Present and future arboviral
threats. Antiviral Res,
2010.
85(2): p. 328-45.
3. Kuno, G., et al., Phylogeny of the genus
Flavivirus. J Virol, 1998. 72(1): p. 73-83.
4. Clyde, K., J.L. Kyle, and E. Harris, Recent advances in
deciphering viral and host
determinants of dengue virus
replication and pathogenesis. J Virol, 2006. 80(23): p.
11418-31.


Comentarios
Publicar un comentario